Questo è uno studio molto lungo e un pò difficile da capire per i non addetti ai lavori.
Ne ho tradotto una piccola parte ma le conclusioni fanno intendere quanto sia importante la vitamina A nella integrazione con la vitamina D nei confronti delle malattie autoimmuni.
Vitamin effects on the immune system: vitamins A and D take centre stage
Astratto
Le vitamine sono costituenti essenziali della nostra dieta e sono note da tempo per influenzare il sistema immunitario. Le vitamine A e D hanno ricevuto particolare attenzione negli ultimi anni poiché queste vitamine hanno dimostrato di avere un effetto inaspettato e cruciale sulla risposta immunitaria. Presentiamo e discutiamo la nostra attuale comprensione dei ruoli essenziali delle vitamine nella modulazione di un’ampia gamma di processi immunitari, come l’attivazione e la proliferazione dei linfociti, la differenziazione delle cellule T helper, l’homing dei linfociti tessuto-specifici, la produzione di specifici isotipi di anticorpi e la regolazione della risposta immunitaria. Infine, discutiamo il potenziale clinico dei metaboliti della vitamina A e D per la modulazione delle risposte immunitarie tessuto-specifiche e per la prevenzione e/o il trattamento dell’infiammazione e dell’autoimmunità.
“Una vitamina è una sostanza che ti fa ammalare se non la mangi.”
(Albert Szent-Gyorgyi, Premio Nobel per la Fisiologia o la Medicina, 1937).
La dichiarazione di Albert Szent-Gyorgyi incarna l’impatto delle vitamine sugli organi vitali del corpo, compreso il sistema immunitario. Le vitamine (ammine vitali) sono composti organici richiesti in tracce nella dieta perché non possono essere sintetizzate in quantità sufficienti da un organismo1. Le vitamine e i loro metaboliti sono essenziali per un gran numero di processi fisiologici, svolgendo diverse funzioni come ormoni e antiossidanti, come regolatori della crescita e differenziazione dei tessuti, nello sviluppo embrionale e nel metabolismo del calcio, tra gli altri1.
Inoltre, le vitamine hanno un ruolo nel sistema immunitario, che si estende alle risposte immunitarie sia innate che adattative. Sebbene alcune vitamine, come le vitamine C ed E e i membri del complesso B, possano agire in modo relativamente aspecifico nel sistema immunitario (ad esempio, come antiossidanti)2-4, altre vitamine, come le vitamine A e D, possono influenzare la risposta immunitaria in modi altamente specifici (vedi Informazioni supplementari S1 (tabella)). Qui esaminiamo gli effetti più importanti delle vitamine sul sistema immunitario, con particolare attenzione alle vitamine A e D, che hanno ricevuto particolare attenzione a causa delle recenti scoperte delle loro molteplici interazioni con il sistema immunitario. Le vitamine A e D sono notevolmente distinte dalle altre vitamine in quanto i loro rispettivi metaboliti bioattivi, acido retinoico e 1,25-diidrossivitamina D3 (1,25(OH)2VD3), hanno proprietà simili agli ormoni. Entrambi questi metaboliti sono sintetizzati dai loro precursori vitaminici da diversi tessuti e cellule del corpo ed esercitano i loro effetti sulle cellule bersaglio a distanza legandosi ai recettori degli ormoni nucleari.
Vitamina D
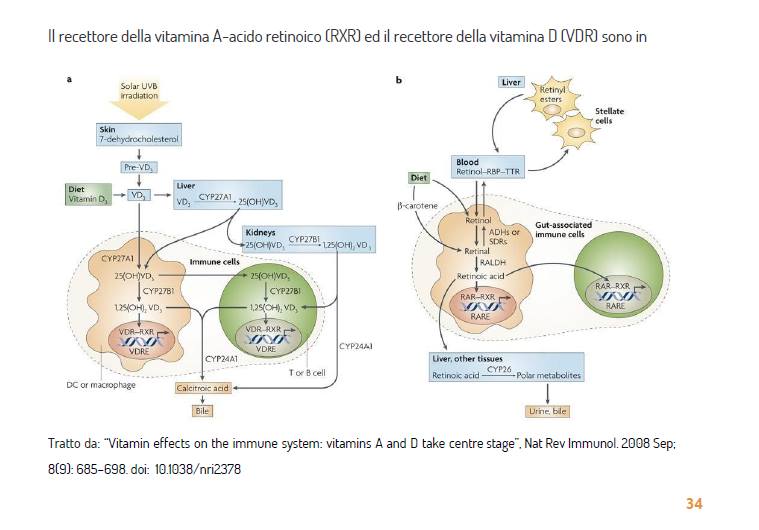
La vitamina D3 (VD3), la forma fisiologicamente più rilevante di vitamina D, è sintetizzata nella pelle dal 7-deidrocolesterolo5, un processo che dipende dalla luce solare, in particolare dalla radiazione ultravioletta B (lunghezze d’onda di 270-300 nm). In alternativa, può essere acquisito con la dieta o con integratori vitaminici5 (FIG. 1a). VD3 viene quindi convertito nel fegato in 25-diidrossivitamina D3 (25(OH)VD3), che è la principale forma circolante di VD3. Infine, il 25(OH)VD3 viene metabolizzato nei reni a 1,25(OH)2VD3, il metabolita VD3 fisiologicamente più attivo5. Oltre ad essere processato nel fegato e nei reni, il VD3 può essere metabolizzato anche dalle cellule del sistema immunitario5,6 (FIG. 1a). In questo modo, l’1,25(OH)2VD3 si concentra localmente in quei microambienti linfoidi che contengono concentrazioni fisiologicamente elevate di VD3, aumentando così la sua azione specifica e limitando anche effetti sistemici potenzialmente indesiderati, come l’ipercalcemia e l’aumentato riassorbimento osseo7.
Le cellule T attivate (e probabilmente anche le cellule B) possono eseguire solo la fase finale di conversione di 25(OH)VD3 in 1,25(OH)2VD3 (REFS 6,8). Tuttavia, i macrofagi e alcune cellule dendritiche (DC), come le DC derivate da monociti e le DC dermiche, esprimono i due gruppi di enzimi necessari per convertire VD3 in 1,25(OH)2VD3 (REFS 6,7,9).
Infine, l’enzima 24-idrossilasi, che è più abbondante nel rene e nell’intestino10, catabolizza l’1,25(OH)2VD3 nel suo metabolita inattivo, l’acido calcitroico, che viene poi escreto nella bile.
Vitamina A
La vitamina A si ottiene dalla dieta come retinolo tutto trans, esteri di retinile o β-carotene11,12 (FIG. 1b). Il retinolo tutto trans viene esterificato in esteri retinilici e immagazzinato nel fegato, principalmente nelle cellule stellate11,12. Nei tessuti, tutto trans-retinolo e β-carotene sono ossidati a tutto trans-retinico da alcool deidrogenasi o da deidrogenasi reduttasi a catena corta, che sono enzimi espressi ubiquitari11,12. L’all-trans-retinale viene quindi ossidato ad acido all-trans-retinoico attraverso una reazione irreversibile catalizzata dalle deidrogenasi retiniche (RALDH), la cui espressione è strettamente controllata. Un metabolita correlato dell’acido all-trans-retinico, 9-cis-retinoico, può essere formato per isomerizzazione spontanea dell’acido all-trans-retinoico o per ossidazione del 9-cis-retinale da parte di RALDH13. Tuttavia, non è stato dimostrato che l’acido 9-cis-retinoico sia sintetizzato in vivo13.
Nei mammiferi adulti, RALDH può essere trovato in alcune cellule associate all’intestino, comprese le cellule epiteliali intestinali (IEC)14,15 e le DC associate all’intestino, come le DC delle placche di Peyer e dei linfonodi mesenterici15,16. È interessante notare che le DC dei cerotti di Peyer esprimono l’mRNA e la proteina RALDH-1, mentre le DC dei linfonodi mesenterici esprimono l’mRNA che codifica per RALDH-2. Sebbene la rilevanza funzionale di questa espressione differenziale dell’isoforma RALDH non sia attualmente chiara, indica che potrebbe esserci più di un percorso o stimolo ambientale che rende le DC capaci di sintetizzare l’acido retinoico dalla vitamina A. Inoltre, le IEC esprimono anche RALDH-1 e possono metabolizzano la vitamina A in acido retinoico in vitro14, il che indica che sono un’altra potenziale fonte di acido retinoico nella mucosa intestinale. I contributi relativi e la rilevanza in vivo di queste diverse fonti di acido retinoico nell’intestino devono ancora essere determinati.
Effetti delle vitamine antiossidanti sull’immunità
È noto da più di 30 anni che alcune vitamine con proprietà antiossidanti, tra cui la vitamina A, la vitamina B6 (piridossina), la vitamina C (acido ascorbico) e in particolare la vitamina E, hanno effetti protettivi su modelli animali di aterosclerosi e danno da ischemia-riperfusione (IRI)2–4. La vitamina E si riferisce collettivamente a otto composti correlati (tocoferoli e tocotrienoli), di cui l’α-tocoferolo ha la maggiore biodisponibilità ed è il meglio caratterizzato105. La vitamina E riduce il rilascio di specie reattive dell’ossigeno da parte dei monociti106 e l’espressione di CD11b e dell’antigene 4 molto tardivo (VLA4), diminuendo così l’adesione dei monociti all’endotelio106. La vitamina E blocca anche il rilascio di citochine pro-infiammatorie, tra cui IL-1, IL-6, TNF e la chemochina IL-8, da parte di monociti e macrofagi107,108. Inoltre, la vitamina E previene la sovraregolazione delle molecole di adesione molecola di adesione cellulare vascolare 1 (VCAM1) e molecola di adesione intercellulare 1 (ICAM1) sull’endotelio indotta dalla lipoproteina a bassa densità ossidata (LDL)109 e IL-1β110, nonché come la sovraregolazione della E-selectina e di alcune chemochine108. Le specie reattive dell’ossigeno attivano la via del fattore nucleare-κB (NF-κB)106, che avvia molti eventi pro-infiammatori. Pertanto, l’effetto antiossidante terapeutico di queste vitamine potrebbe essere spiegato, almeno in parte, dalla loro capacità di ridurre l’attivazione di NF-κB.
La vitamina E può anche agire direttamente sulle cellule T diminuendo la produzione di IFNγ111 e l’espressione di CD95L (noto anche come FASL)112, contribuendo così a ridurre l’infiammazione e il danno tissutale immuno-mediato. Si ritiene che questi effetti sui macrofagi e sulle cellule T siano importanti per l’effetto protettivo della vitamina E nei modelli animali di aterosclerosi108,113 e IRI114,115. Coerentemente con un potenziale ruolo fisiologico della vitamina E nella prevenzione dell’aterosclerosi, i topi iperlipidemici che sono carenti nella proteina di trasferimento dell’α-tocoferolo, che è importante per il trasporto dell’α-tocoferolo e per prevenirne la degradazione, hanno un’aterosclerosi più grave116.
È stato recentemente dimostrato che la vitamina C previene il danno ossidativo durante la riperfusione ischemica nei ratti117 e nell’uomo4. In particolare, è stato dimostrato che la vitamina C, ma non la vitamina E, previene l’adesione dei leucociti all’endotelio microvascolare nei modelli di criceto di stress endoteliale ossidativo indotto dal fumo di sigaretta o dalle LDL ossidate118,119. Le differenze nella lipofilia potrebbero potenzialmente avere un impatto sulla distribuzione e/o sulla localizzazione delle vitamine C ed E e in parte spiegare l’effetto differenziale di queste vitamine. Pertanto, è possibile che l’integrazione combinata di vitamine C ed E possa offrire benefici sinergici. Il ruolo antiossidante e/o anti-aterogeno di altre vitamine, come la vitamina B6 e la vitamina K, è meno ben documentato e alquanto controverso, con prove sia a favore120,121 che contro122 di un ruolo protettivo di queste vitamine nell’aterosclerosi.
Infine, va notato che molti dei risultati incoraggianti nei modelli animali non sono stati costantemente tradotti in un significativo beneficio terapeutico negli studi clinici controllati di integrazione vitaminica per la prevenzione delle malattie cardiovascolari e IRI121. Pertanto, resta da determinare se le vitamine antiossidanti si dimostreranno utili per il trattamento e/o la prevenzione di questi disturbi nell’uomo.
Sebbene 1,25(OH)2VD3 eserciti chiaramente attività immunomodulatoria in vitro e in vivo, il suo ruolo fisiologico relativo nel mantenimento della tolleranza immunitaria e nel plasmare le risposte immunitarie non è ancora chiaro. Inoltre, poiché l’acido retinoico e 1,25(OH)2VD3 possono potenzialmente antagonizzare gli effetti reciproci6,18,99, sarà importante analizzare l’interazione tra 1,25(OH)2VD3, acido retinoico e altri meccanismi di immunomodulazione in vivo .
L’1,25(OH)2VD3 può sovraregolare il CCR10 sulle cellule T umane e sulle ASC6,39 bloccando l’espressione dei recettori per la pelle e l’intestino6,99. Tuttavia, resta da determinare la rilevanza in vivo degli effetti di 1,25(OH)2VD3 sull’espressione di CCR10 da parte delle cellule T che si stanno infiltrando nella pelle e delle ASC IgA+ che stanno migrando verso la lamina propria dell’intestino. Inoltre, sebbene le DC residenti nel GALT aumentino la secrezione di IgA e inducano linfociti effettori intestinali ex vivo, sarà importante determinare il relativo contributo in vivo delle DC rispetto ad altre potenziali fonti di acido retinoico nell’intestino (come le IEC), e per determinare se esistono meccanismi indipendenti dall’acido retinoico di imprinting di un fenotipo gut-homing. Inoltre, poiché le DC residenti in GALT possono anche migliorare la differenziazione delle cellule TReg indotte da TGFβ, sarà necessario determinare gli scenari in vivo in cui le DC residenti in GALT e l’acido retinoico promuovono le risposte delle cellule T effettrici o soppressive. Sulla stessa linea, sarà importante studiare il contributo di queste cellule TReg intestinali generate in situ rispetto alle loro controparti sistemiche nel mantenere la tolleranza immunitaria nei siti intestinali ed extra-intestinali.
A parte gli effetti antiossidanti delle vitamine C ed E che sono stati dimostrati in modelli animali di malattie cardiovascolari e IRI, mancano informazioni pubblicate sull’impatto di queste e altre vitamine, come la vitamina B6 e K120-122, sulla sistema immunitario adattativo e in altri contesti infiammatori, come le malattie autoimmuni. Non è chiaro se queste vitamine offriranno un beneficio terapeutico nei contesti di malattie cardiovascolari umane, IRI e altre patologie.
Sebbene rimangano molte domande aperte, vi è la promessa che i metaboliti della vitamina A e D o i loro analoghi abbiano il potenziale per essere utilizzati in contesti clinici per benefici terapeutici. In particolare, sarà importante valutare l’impatto dell’utilizzo degli analoghi dell’1,25(OH)2VD3 come terapia immunomodulante adiuvante nell’ambito delle malattie autoimmuni e nei trapiantati. Sarà anche importante determinare gli effetti netti dell’acido retinoico o degli agonisti RAR sintetici, specialmente nell’intestino, dove questi agenti sembrano avere un ruolo nel migliorare le risposte immunitarie. La capacità dei metaboliti della vitamina A di promuovere le cellule T intestinali potrebbe migliorare le strategie di vaccinazione della mucosa o aiutare a ridurre l’immunità patogena potenziando l’induzione delle cellule TReg.
Liberatoria (Disclaimer)
Dichiarazione di non responsabilità: questo articolo non è destinato a fornire consulenza medica, diagnosi o trattamento.
Vitamineral non si assume responsabilità per la scelta degli integratori proposti eventualmente nell’articolo.


